目前,印尼关于医药及医疗器械进口及分销主要依照2021年的《新投资清单》、药品和食品监管机构(BPOM)制定的具体法规(如,BPOM 2020年第27号法规、BPOM 2020年第11号法规)。相关规范如下:
一、药品方面
药品产品都必须获得BPOM的销售许可证才能在印度尼西亚境内进行分销。值得注意的是,印度尼西亚不允许转让前述许可,而需先注销之前的许可证,后由新主体申请新的许可证。
(1)药品注册分类
根据印尼《药品注册条例》第5条之规定,印尼药品注册的分类及类别如下:
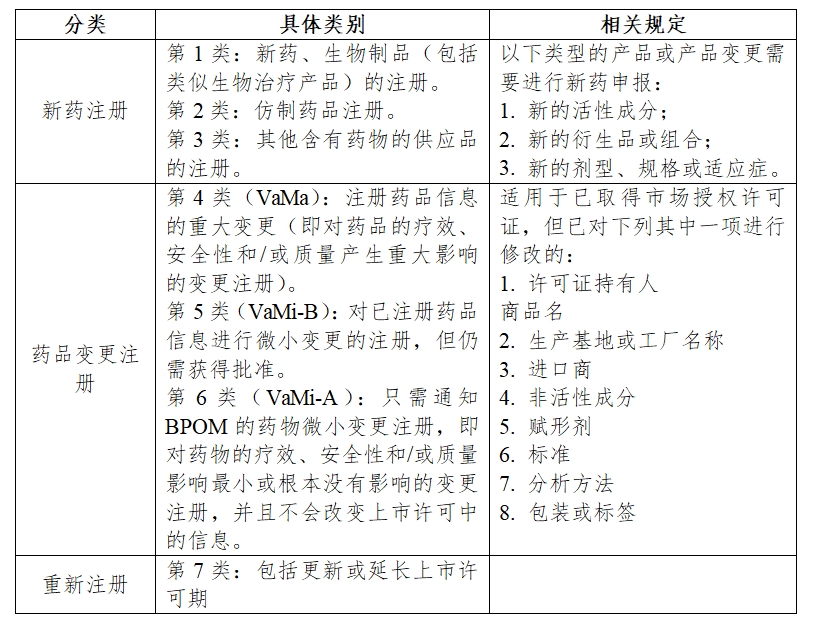
(2)药品注册流程

二、医疗器械方面
印尼医疗器械主要法律法规为2017年第62号规范《医材、IVD医材及家庭保健用品(PKRT)销售许可准则》、卫生部2020年第3号《医院分类及许可条例》及《回收市场上含汞医材公告》。
医疗器械的进口与分销流程在印尼较为复杂,特别是分销渠道与产品合规两大方面。印尼法律明确规定,从事医疗器械销售的公司必须是持有合法经营授权书的本地注册实体,所有进入印尼市场的进口医疗器械,均须历经严格的注册审批程序,并且需同时取得产品注册证及医疗器械分销许可证(NIE),方可进入印尼市场。
另外,印尼医疗器械注册体系是“独家代理制”,即单个制造商仅能指定一家印尼公司作为其产品在印尼的唯一注册与进口代理,且此代理关系在产品注册有效期内具有排他性,分销商需获得独家代理商授权、且仅能通过该代理商进货。这一制度虽有助于市场管理,但对于外国投资者而言存在诸多问题,如代理商更替难度大、市场内可能出现的不良竞争行为,以及因独家代理关系而引发的商业秘密保护问题等。
(1)上市前的产品要求
①产品注册许可证
在获得产品注册许可证前,印尼境内的医疗器械销售公司还须获取由印尼卫生部直接颁发的分销许可,即医疗器械销售许可(IPAK)。许可的申请流程可通过专门的在线电子注册系统启动,申请者需准备相应文件,包括(以申请时官方实际要求为准):(1)执行摘要,需概述产品的销售历史、预期用途、已获监管许可证或营销许可证的清单、待审理的营销许可申请的状态描述,以及任何重要的安全或性能考量;(2)详尽列出拟向印尼卫生部注册的医疗设备的具体信息;(3)证明产品合格的基本原则和方法;(4)符合性声明,证明产品符合印尼及国际相关标准;(5)设备详细描述,包括技术规格与功能特点;(6)设计验证与确认报告,确保产品设计达到预期的安全与性能标准;(7)设备标签样本,符合印尼市场要求的标签设计;(8)风险分析;(9)制造商的详细信息,包括资质证明与联系方式等。

图:印尼医疗器械注册流程
而对于拟投放市场的医疗器械,必须完成注册申报流程,且依据产品的不同分类与风险等级,注册评审周期会有所差异。各类医疗器械的评审周期各不相同,旨在确保每一款产品都能经过充分的评估,以保障公众健康与安全。具体如下:
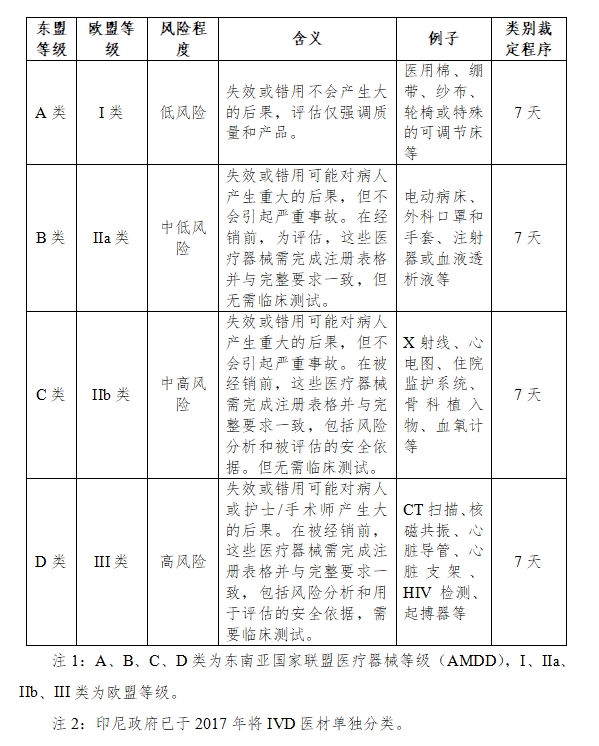
值得注意的是,医疗器械进入印尼市场的流程较为特殊,实体代理商需先获得由印尼大使馆颁发的经营授权书,并由制造商出具产品确认信。印尼政府针对进口医疗企业所颁发的注册证书,其有效期设定为五年,与我国的相关政策相类似。在注册证书即将到期之前,企业需至少提前六个月提交延续注册的申请,以确保注册的连续性和有效性。
此外,若发生以下重要变更情况,企业需按照新注册流程重新申请注册:包括生产地址的迁移、商品名称的更改、产品适用范围的调整,以及证书持有人的变动。而对于一些非关键性的变动,如产品新增型号、标签及说明书中的微小修订、灭菌场地的变更,以及/或技术指标的微调,企业则需进行变更注册,以适应这些变化并确保产品信息的准确更新。
②医疗器械分销许可证
而对于医疗器械分销许可证(NIE),NIE要求承诺严格遵守所有标签与包装规范,同时确保每类产品均满足其独特的特定条件,以及针对特定选定设备可能设立的任何特殊需求。通常要求每6个月提交一次产品的电子报告,以保持信息的时效性与准确性,内容包括产品名称、批次号/生产序列号、有效期等核心信息,同时,为了提升透明度与可追溯性,还需附加制造商及分销商的详细数据。此外,还需包括设备的核心组件清单、详尽的使用说明,以及在使用或操作产品过程中必须遵循的所有警告与注意事项。
(2)上市后的产品监管
医疗器械上市后监管措施则参照东南亚国家联盟医疗器械指导,包括抽样检测(Sampling)、监督(Monitoring,即不良事件监测)、警告(Vigilance,即识别缺陷设备和不良事件报告的警报系统)等。
另外,印尼还明确规定了国产及进口医疗器械标签,应当同时使用原产国语言和印尼语。标签内容包括:产品名称、图⽰制造商的名称和地址、注册证号、批号、印尼语或者英语提⽰的警告、使用手册和IFU。
本文由李新立律师团队编辑整理,并经印度尼西亚AGA律师事务所管理合伙人Andika Edwin Pahlevi律师审核。
【参考文件】
1. 印尼医疗器械上市法规与销售规定,https://nsp.mohw.org.tw/cp-3351-4632-44d76-1.html
2. 印尼医疗和医药行业外商投资新规,https://mp.weixin.qq.com/s/8YXoeJYATQBY2GodAYeY6g
3. 山海图科技:印尼医疗器械的法律规定,https://mp.weixin.qq.com/s/AEjgk-x_qfhXLTa4yRP9dw
4. 涉外法律问答系列|印度尼西亚医疗器械注册指南,https://mp.weixin.qq.com/s/vGT260REIytj8un3nLpXoQ
5. 医疗器械出⼜印度尼西亚需要什么认证,https://www.jd-link.com/articles/encyclopedias/1780/
6. 医疗器械扬帆出海(东盟篇)——印度尼西亚注册详解,https://mp.weixin.qq.com/s/InU9XFMLrMzwRN4C7GSUKg
7. 干货|印尼医疗器械市场准入攻略,https://mp.weixin.qq.com/s/1rJMbnfYhIWYKTy_wV7rUg
8. 印尼医疗器械注册简易指南, https://mp.weixin.qq.com/s/bCQqfQB7JcEzYI2n5KRVCA
9. 印度尼西亚的药品注册流程, https://mp.weixin.qq.com/s/po1ftkOmpl08mi4i__Xohw
10. 【印尼创业谈】印尼药品注册投资指南:市场准入与合规策略,https://mp.weixin.qq.com/s/Q4Vx2bQEygPLD0qs4ICq7Q
