一、外资占比限制
在医药成品及原材料领域中,《新投资清单》取消了《2016年负面清单》下医药产品成品制造“外资占比不超过85%”的限制。除传统医药外,外资可以直接进入;而在医疗器械制造领域,《新投资清单》同样取消了《2016年负面清单》下“A类医疗设备外资占比不超过33%;B类、C类和D类医疗设备不受限制,但需要取得卫生部的特别许可”的要求。至此,《新投资清单》开放了在医药成品、医药原材料及医疗器械领域的外资占比限制,外资可以进入印尼市场设立纯外资的药厂或医疗器械厂。
在医药成品及原材料领域中,《新投资清单》取消了《2016年负面清单》下“医药产品原料分销100%内资所有;医药产品成品分销受印尼卫生部及食药局不成文政策限制、不开放”的要求。除传统医药外,外资可以从事该领域分销业务;而在医疗器械领域,《新投资清单》同样取消了《2016年负面清单》下49%的外资限制,可进口及分销医疗设备。
外资在医药成品、医药原材料及医疗器械的进口及分销领域均可100%持股。
二、政府许可
1. 医疗器械的制造
印尼医疗器械的制造商(非个人)应申请取得制造许可证书,申请原则上向省级卫生机关提起,并需要提交:
(1)警察调查报告;
(2)工厂负责人资料;
(3)履行医材优良制造标准的承诺书;
(4)制造开发计划。
若展延或变更申请,需提交生产报告电子文件及符合优良制造标准的证书。
卫生机关将组织县市卫生主管机关或专家学者,以稽查小组的形式进行实地稽查,经稽查符合GMP规范的,向中央卫生部提出核发制造证照的建议函。
2. 医疗器械的上市
医疗器械需经印尼全国单一窗口(Indonesian National Single Window,INSW)申请上市许可,并经上市许可证持有者(MAH)安排后续销售
若国内制药厂的主要业务是依赖进口的医疗器材零部件组装医疗器材,那么这些关键功能性的零部件应当在印度尼西亚本地生产,并且,在生产过程中,应优先使用印尼本土的原材料,确保本地原料的使用量超过外国进口原料。此外,整个制造与组装流程的大部分工作也必须在印尼境内完成,唯有满足这些条件,该制药厂才有资格申请在印尼市场上销售其医疗器材的许可。
上市许可证的有效期限最长可达五年,持有人最早可在许可证有效期满前九个月内向印尼卫生部药品与医材总局提交延期申请。若未在规定时间内申请延期,则需按照新申请案的程序重新提交上市许可申请。值得注意的是,一旦制造证书失效,相关联的上市许可证也将自动视为无效。
对于未经申请上市许可或伪造上市许可而擅自销售医疗器材,并因此导致使用者健康遭受严重损害、残疾甚至死亡的情况,相关责任人将面临刑事责任的追究。
相关流程如下:
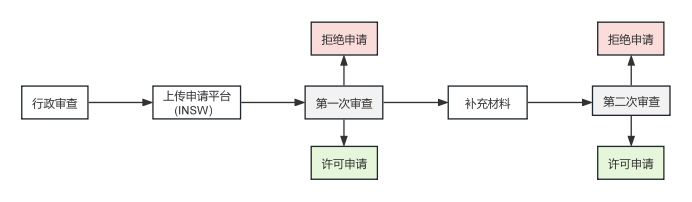
3. 医药行业
就医药行业而言,外国投资者可以选择设立外商直接投资有限公司(PT PMA)或通过收购现有公司的方式进入印尼市场
值得注意的是PT PMA只能进行大规模商业活动,即投资价值、注册资本及实缴资本均不少于100亿印尼盾。根据《关于资本投资的2007年第25号条例》《关于有限责任公司的2007年第40号条例》和《关于对2021年第10号〈关于投资企业部门的总统条例〉进行修订的2021年第49号总统条例》,设立程序如下:(1)向法律和人权部注册公司名称;(2)向投资协调委员会注册批准主要许可证;(3)在公证处起草公司章程;(4)从法律和人权部获得公司设立证书;(5)获得纳税人编号;(6)从地方政府注册公司注册证书。
本文由李新立律师团队编辑整理,并经印度尼西亚AGA律师事务所管理合伙人Andika Edwin Pahlevi律师审核。
【参考文件】
1. 印尼医疗器械上市法规与销售规定,https://nsp.mohw.org.tw/cp-3351-4632-44d76-1.html
2. 印尼医疗和医药行业外商投资新规,https://mp.weixin.qq.com/s/8YXoeJYATQBY2GodAYeY6g
3. 医疗器械出口印度尼西亚需要什么认证,https://www.jd-link.com/articles/encyclopedias/1780/
