(一)医药类产品注册及分销
- 外资限制
在越南,外国投资者可以从事药品、药材的进口工作,但是不得进行药品的分销以及与药品分销相关的活动(除非分销药品及药材是由外国投资者在越南自主生产的)。
根据越南加入WTO服务领域具体承诺表及第09/2018/ND-CP号法令第3条第4款,药品分销包括批发和零售活动,代理商品销售和特许经营活动。而根据卫生部药品监督管理局2018年3月14日第43388/QLD-PCD号公文《关于实施指导《药剂法》的第54/2017/ND-CP号令》(Official Dispatch No. 43388/QLD-PCD on the implementation of Decree 54/2017/ND-CP guiding the Law on Pharmacy)、第54/2017/ND-CP号法令(Decree 54/2017/ND-CP),药品分销相关活动的涵盖的内容则更加广泛,包括:药品及药材的运输与储存;确认及实施其他药品经营单位经营的药品和药材的销售价格;确定由其他医药单位经销的药品和原料药的销售策略和经营方针;制定为越南的卫生保健设施供应药品及药材的计划;对直接向企业购买药品、原料药的组织和个人,以操纵进口药品、原料药销售为目的,提供任何形式的资金支持;与药品分销有关的其他行为。
- 医药类产品的注册
作为进口的必要前提,所有医药类产品在上市前需经越南药品监督管理局(DAV)注册,根据2016年医药法的规定,注册流程如下:
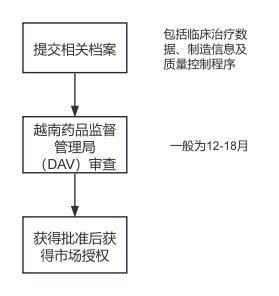
- 新法修订的积极影响
值得关注的是2016年医药法的修改(将于2025年7月1日生效),为外国投资者开放了更多的市场通道,同时标志着越南药品分销市场从保护主义逐步转向市场自由主义。具体而言,根据《药剂法》(the Law on Pharmacy)第53条修正案规定,外商投资企业可以:
(1)通过与其附属企业的技术转让协议,回购在越南生产的药品和原料药;
(2)与同一外商投资企业签订技术转让协议的当地制药公司进口原料药;
(3)向批发商分销进口、外包或许可出口的药品和原料药;
(4)进口和分发用于人道主义援助和疾病预防/控制项目的药品;
(5)为外商投资企业资助的临床试验提供进口药品和原料药,确保根据技术转让协议从仓库直接运送到临床试验设施。
此外,根据修改后的法律,针对专门用于政府批准的临床试验的产品,制药公司可以进口没有上市许可或进口许可证的药品。
受到《欧盟-越南自由贸易协定》(European Union-Vietnam Free Trade Agreement, EVFTA)影响,2019年越南卫生部(MoH)首次授予海外药品制造商进口证书,尽管新法已经解除了部分限制,外国药品制造商仍然只能专门向当地批发商或制造商销售其产品,不能从事直接药品分销。
(二)医疗器械产品注册及分销
- 主管机构及法律法规
越南允许外国投资者从事医疗器械的进口及分销工作,医疗设备主要由卫生部下属的医疗设备和建筑部(DMEC)管辖,依据第98/2021/ND-CP号法令、《产品与商品质量法》(Law on Products and Goods Quality)、第19/2021/TT-BYT法令,对医疗设备的分类及注册、产品质量管理体系、上市后监督、出口/进口控制进行监管。
- 越南医疗器械的分类及注册要求
越南的医疗器械分类与东盟医疗器械指令(ASEAN Medical Device Directive,AMDD)一致,主要依据使用医疗器械可能存在的风险进行分类,如果一个设备有多个不同风险级别的用途,则按照最高的风险级别进行分类。不同类别的医疗器械在注册流程、审核时间、注册费用等方面存在差异,相关规定如下:
| 类别 | 风险程度 | 注册费用(VND) | 示例 |
| A类 | 低风险 | 1,000,000 | 医用检查床、压舌板 |
| B类 | 中低风险 | 3,000,000 | 手术手套、注射器 |
| C类 | 中高风险 | 6,000,000 | 外科植入物、牙科植入物 |
| D类 | 高风险 | 6,000,000 | 心脏瓣膜、可植入除颤器 |
- 注册及进口流程
只有依法注册的医疗器械可以进口至越南,同时进口商必须持有有效的营业执照,外资公司需要指定本地授权代表(LAR)协助进口程序。具体而言,进口医疗设备需要取得的文件与注册时所需文件相似,即:合格证书(Certificate of Conformity)、担保资格证书(Certificate of Eligibility to Provide Warranty)、体外器械的检验证明(如需)(Certificate of Inspection)。
越南医疗器械的注册流程如下:
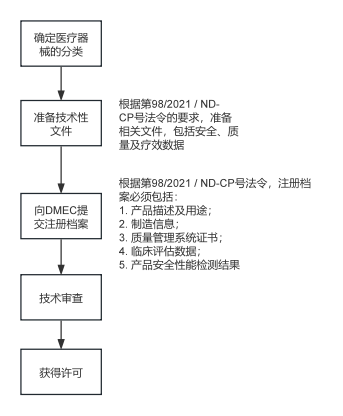
完成注册后,外国制造商可通过指定越南本地的代表或设立越南实体的方式,进口医疗设备。进口的医疗设备必须持有进口证书,并符合越南的清关及产品标签规范(详见下文)。
申请进口证书的申请必须包括书面申请、医疗设备分类、产品注册证书或同类型文件、销售合同、商业发票及装箱单、提单。DMEC在收到前述完整有效的文件后,应在15个工作日左右进行处理。
- 标签规范
越南市场对于标签的合规性管理较为严格。为避免有权机关的处罚,在分销医疗器械的过程中,外国投资者需要额外关注:
(1)标签的内容上,需要包括:产品名称、医疗设备厂家的姓名及地址、注册人的姓名及地址、登记号码或进口证号码、批次号或序列号、生产日期或失效日期、警告、使用及储存说明、原产地。
(2)语言规范:所有标签必须使用越南语。产品标签是外文的,则必须在不改变原始标签的情况下补充越南语标签。
5. 上市后监管
医疗设备的制造商及进口需要在医疗设备上市后仍保持对其安全性能的严格管控,具体包括:
(1)设置质量监督管理系统,确保设备上市后质量仍符合法规的相关要求及标准;
(2)不良事件报告义务,如发生设备故障或健康并发症等不良事件,必须及时报告监管机构;
(3)建立产品追踪机制,确保产品可以被快速及有效地召回;
(4)定期进行安全性能更新,确保有关机关能及时了解产品相关风险。
