国家药品监管局(NPRA)监管制药行业由马来西亚卫生部负责,所有药物/药物的药用剂型和化妆品必须在NPRA下的药品管理局(DCA)注册后才能进入马来销售和营销。
(一)医药类产品注册
- 主管机构
NPRA隶属于卫生部,于2002年1月1日加入药剂检验合作计划,成为第26位成员。NPRA负责医药类产品的监管控制,以确保药品的质量、疗效和安全性以及在国内销售的传统药品和化妆品的质量和安全。自2002年以来,它一直积极参与国际良好生产规范(GMP)和质量保证计划。
DCA是根据1984年《药品和化妆品管制条例》设立的执行机构,以确保在马来销售的药品、传统药品、保健品、兽医产品和个人护理产品的安全、质量和功效。
- 法律法规
《药品注册指导文件指南》(DRGD)根据1952年《药品销售法》、1984年《药品和化妆品管制条例》及其他相关法例制定,申请人须确保产品符合1952年《危险毒品法令》、1952年《毒药法》、1956年《医药(广告和销售)法》、1983年《专利法》和其他相关法令的规定。
NPRA对药品注册的要求与世界卫生组织的质量、安全和功效指南和建议或其他国际公认的标准(如国际协调会议)保持一致。
- 产品范围
根据1984年《药品和化妆品管制条例》第2条,“产品”被定义为具有单一身份、成分、特性和来源的药物(以药剂形式)或化妆品。另根据1952年《药品销售法案》,“药品”包括任何物质、产品或物品,旨在用于或能够用于,或声称能够用于人类或任何动物,无论是内部还是外部用于人类(和动物)的医疗目的。
根据1984年《药物和化妆品管制条例》(2006修订版)规定,所有产品在制造、销售、供应、进口、加工或管理之前都必须向DCA注册,该条例的特定条款另有规定除外。
任何以药物剂量形式存在的、打算用于人类或任何动物或能够、声称可用于人类或任何动物的药物,无论是用于医疗目的的内部还是外部,都必须向DCA注册。具体产品分类如下:
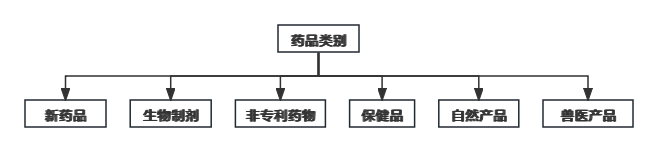
- 注册程序
产品许可证持有人、制造商、进口商、再包装商及经销商和其他相关用户可以通过NPRA的QUEST 3+在线提交系统办理在线业务,包括注册、请求更改、市场抽样和续期。申请人须注册为NPRA成员,并购买包含用户数字证书的USB令牌。
产品注册申请人,即产品注册持有人(PRH),必须是在当地注册成立的公司、法人或法人实体,具有永久地址,并在马来西亚公司委员会(SSM)注册。PRH(包括产品制造商)的名称不得包括政府机构、高等教育/研究机构、反映药品质量、疾病名称及器官名称。
- 注册流程
产品注册过程应当确保药品的安全性、有效性和质量得到评估,而天然产品则在管理局注册和投放市场之前对其安全性和质量进行评估。
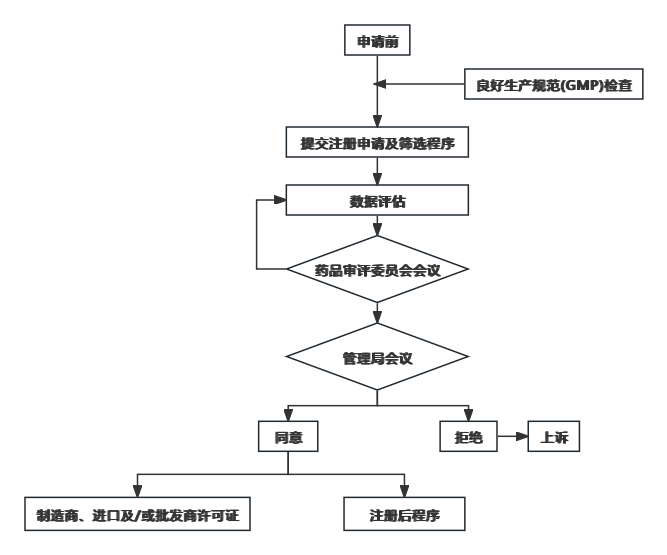
- 产品注册的评估时间表
| 全面评估 | 评估时间(工作日) | |
| 1 | 新药(NCE) | 245(注) |
| 2 | 新药(Hybrid) | 210(注) |
| 3 | 生物制剂 | 245(注) |
| 4 | 仿制药(表列毒药) | 210(注) |
| 5 | 仿制药(非表列毒药) | 210 |
| 6 | 降低疾病风险的健康补充剂 | 245 |
| 7 | 具有治疗功效的天然产品 | 245 |
| 简略评估 | 评估时间(工作日) | |
| 8 | 仿制药(非表列毒药)a)单一活性成分b)两种或两种以上的有效成分 | a)116b)136 |
| 9 | 天然产物a)单一活性成分b)两种或两种以上的有效成分 | a)116b)136 |
| 10 | 健康补充剂a)单一活性成分b)两种或两种以上的有效成分 | a)116b)136 |
注:上述时间表可能不适用于以下情况:
(1)对于在产品评估期间提交的新数据(涉及主要证明文件)需要全面审查的产品。
(2)对于具有三个以上适应症的产品和/或需要广泛审查的产品。
- 清真标识(HALAL logo)的使用
马来西亚以伊斯兰教为国教,根据2023年马来西亚统计局报告,穆斯林人口约占总人口的60%。因此,需额外关注产品中清真标识的使用问题。除伊斯兰发展部(JAKIM)的认证和批准外,标识不能用于药品产品(含有未列入毒物清单的物质的产品)、传统产品、膳食补充剂和化妆品(非处方药(OTC)除外)。
(二)医疗器械方面
- 主管机构
马来西亚医疗器械注册的主管机构为卫生部下的医疗器械管理局(MDA),主要依据2012年《医疗器械条例》、2012年《医疗器械法》进行管理。
- 医疗器械分类及注册要求
马来西亚2012版《医疗器械法》与美国及欧盟相似,具体分类及示例如下:
| 类别 | 风险程度 | 产品举例 | 申请费用(RM) | 注册费用(RM) |
| A类 | 低风险 | 简单手术器械、压舌器、检查灯、简单伤口敷料、氧气面罩等 | 100 | / |
| B类 | 中低风险 | 皮下注射针头、抽吸设备、麻醉呼吸回路、吸引器、助听器、水凝胶敷料、光疗机和X射线机等 | 250 | 1,000 |
| C类 | 中高风险 | 肺呼吸机、矫形外科植入物、婴儿保育箱、血液氧合器、创伤敷料、除颤器、放射性治疗设备和呼吸机等 | 500 | 2,000 |
| D类 | 高风险 | 起搏器及导线、植入式除颤器、植入式输液泵、心脏瓣膜、神经导管、人造血管和支架等 | 750 | 3,000 |
注:除上述类别医疗器械外,含药器械的申请费为750RM、注册费为5,000RM。
- 注册流程
医疗器械需经马来西亚的医疗器械集中在线申请系统(MeDC@St)提交申请。其中,A类医疗器械由MDA审查批准,其他类别由CAB(Conformity Assessment Body)进行符合性评估。注册流程如下:
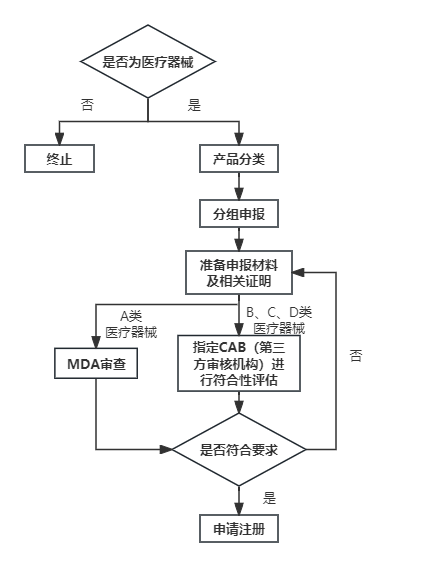
- 其他事项
(1)语言上,家用器械说明书和标签需为马来文,专业人士使用的说明书和标签可为英文。
(2)非本地制造商须指定马来西亚授权代表,负责医疗器械的注册申请、上市监督及与官方机构沟通等事宜。代表必须为马来西亚公民/永久居民或马来西亚的注册公司,并持有场地证书和医疗器械良好分销规范(GDPMD)证书。
(3)产品注册批准后,制造商需进行上市监控等,包括但不限于报告不良事件和定期更新技术文件。
本文由李新立律师团队编辑整理,并经马来西亚WOON WEE YUEN&PARTNERS律师行吴佩珍律师(马来西亚)、陈祥辉实习律师(马来西亚)审核。
【参考文件】
- MALAYSIA’S PHARMACEUTICAL INDUSTRY: A FAST-GROWING FORCE,https://www.mida.gov.my/wp-content/uploads/2020/07/7.-Pharmaceutical-SIB-2022-2023.pdf
- https://www.npra.gov.my/index.php/en/component/sppagebuilder/925-drug-registration-guidance-document.html
- 《【东南亚】马来西亚器械注册一览》,https://mp.weixin.qq.com/s/kkFeExGLKpIun4rbcHClSg
- 《国际注册 | 马来西亚医疗器械注册指南》,https://mp.weixin.qq.com/s/V5LvCNvV950I7vxFWVc3dw
- 《海外注册 | 一分钟看懂马来西亚医疗器械注册》,https://mp.weixin.qq.com/s/mclXzEzFuMYLAIfdGaQySQ
- 《【注册解读】马来西亚医疗器械注册流程解读》,https://mp.weixin.qq.com/s/wAYfK7Ig_HbZUvlD0hHK9A
- MALAYSIA: INVESTMENT IN THE SERVICES SECTOR-MEDICAL AND HEALTHCARE SERVICES
